F-627因旅行限制推迟上市批复 亿帆医药称竭力推动其尽快上市
2022-04-01 16:00:41 来源: 证券日报网
本报记者 吴文婧
3月31日晚间,亿帆医药公告称,控股子公司Evive Biotech Ltd.(下称“亿一生物”)在研产品艾贝格司亭α注射液(以下简称“F-627”)用于预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症于2022年3月31日(美国时间2022年3月30日)收到美国食品药品管理局(以下简称“FDA”)的邮件通知,因旅行限制,FDA将推迟F-627上市申请批复,直到现场检查完成。
亿帆医药方面表示,推迟上市申请批复并非F-627项目本身导致的延期。截至目前公司亿一生物就FDA对F-627技术审评过程中提出的问题均全部回复。公司将积极做好生产现场核查前的准备工作,随时迎接FDA的现场检查,竭力推进F-627尽快上市。
有医药行业人士向记者分析称:“按FDA的操作规程,有理由推断FDA对F-627上市申请的技术审评已经通过。”
根据FDA的通知:“将持续关注公共卫生形势及旅行限制政策,一旦安全旅行得以恢复,并在公共卫生和其他因素允许的情形下,我们将积极明确一种方法,以完成目前尚未完成的现场检查。”
“近期有国内药企拟在美国进行临床试验或上市申请的尝试受挫,让投资人对于中国药企能否出海的信心逐步减弱,甚至产生了怀疑。而F-627国内外开展的全球多中心I期、II期及III期临床试验,均圆满达到临床试验预设目标,且在FDA完成了两个三期临床试验。”前述行业人士表示,“亿一生物本次收到FDA的通知,与之前其他企业的失利是大有区别的。亿一生物F-627美国、欧洲能否上市的时间节点终将明确,希望能让关注中国一批创新生物药顺利出海的从业者与投资者,多一份期待与信心。”
(编辑 张明富)
热门资讯
-
F-627因旅行限制推迟上市批复 亿帆医药称竭力推动其尽快上市
-
403分,考研成功!脑瘫小伙的新目标更励志
-
5所尴尬的北京“大学”,没有A类学科,被质疑实力不如普通学院
-
中传曝艺考成绩!00后林恩赐或成康辉师弟,“小戏骨”边程表现平平
-
4月起铁路系统开始招人,国企六险二金,大专学历也可以去
-
太震惊!考研名师张雪峰声称:我女儿以后可以不考研,因为已经给她赚够了。
-
985大学排名再次“洗牌”,华中科大引发争议,武大险些跌出前十
-
“铁饭碗”排行榜重新洗牌,教师无缘前5名,榜首备受众人青睐
-
中国最好的4所体育大学,武体、成体上榜,有你的母校吗?
-
2022年湖北建筑施工特种作业人员考核管理系统
-
被改名“拖累”的211大学,原名简洁大气,改完却一身“野鸡味”
-
OMG|线上艺考到底有多离谱?
-
宝丰镇红卫小学开展防震减灾疏散演练
-
淄博新经济下的双结合——博物馆结合学校发挥文化教育
-
严禁采集家长职务和收入信息!教育部明确
-
观债|一季度发行地方债1.8万亿,二季度或延续小高峰态势
-
公募基金去年利润超七千亿,广发、天弘、富国基金跻身前三甲
-
A股二季度开门红:交通运输板块涨幅靠前,旅游白酒表现抢眼
-
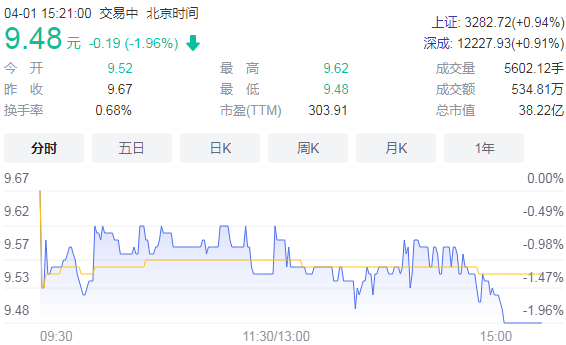
上纬新材发布2021年全年业绩报告 盈利同比下滑近九成
-
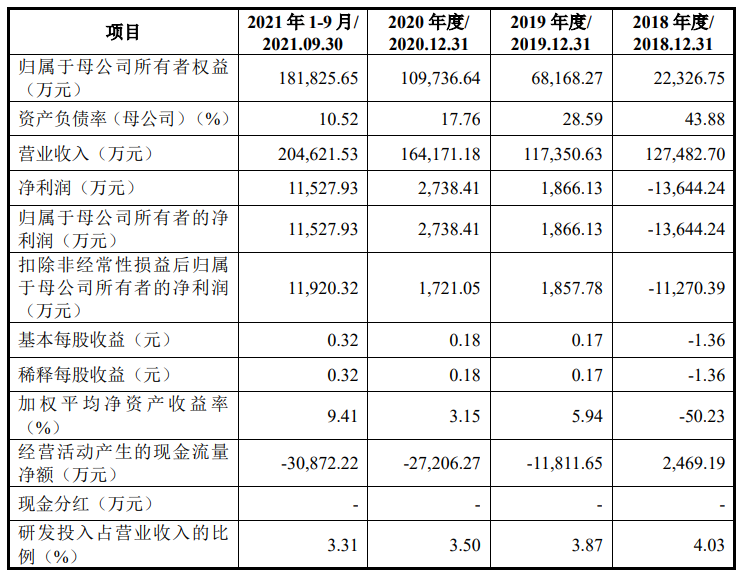
拟募资8亿元 佰维存储科创板IPO获上交所受理
-
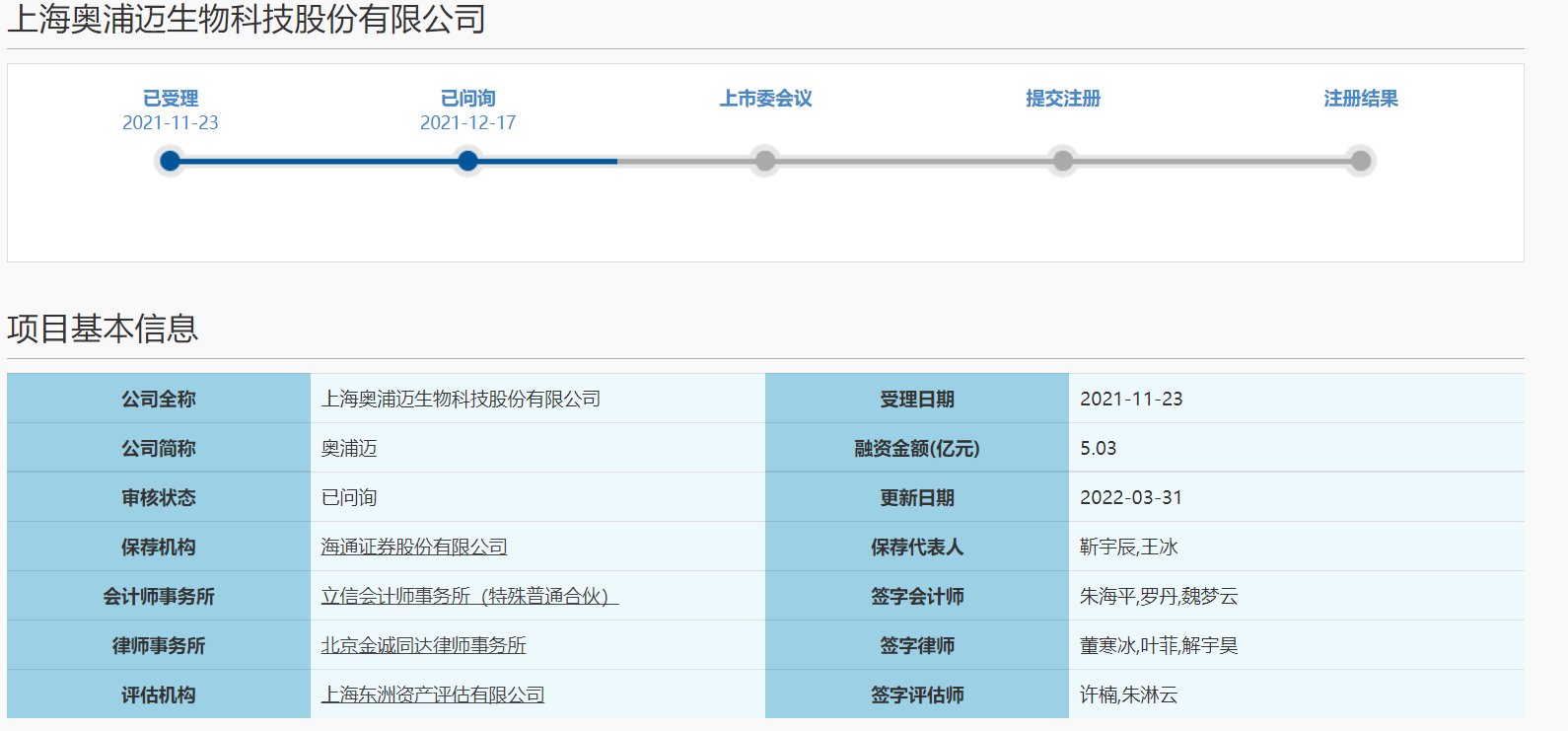
奥浦迈回复科创板二轮问询 上交所主要关注七个问题
-
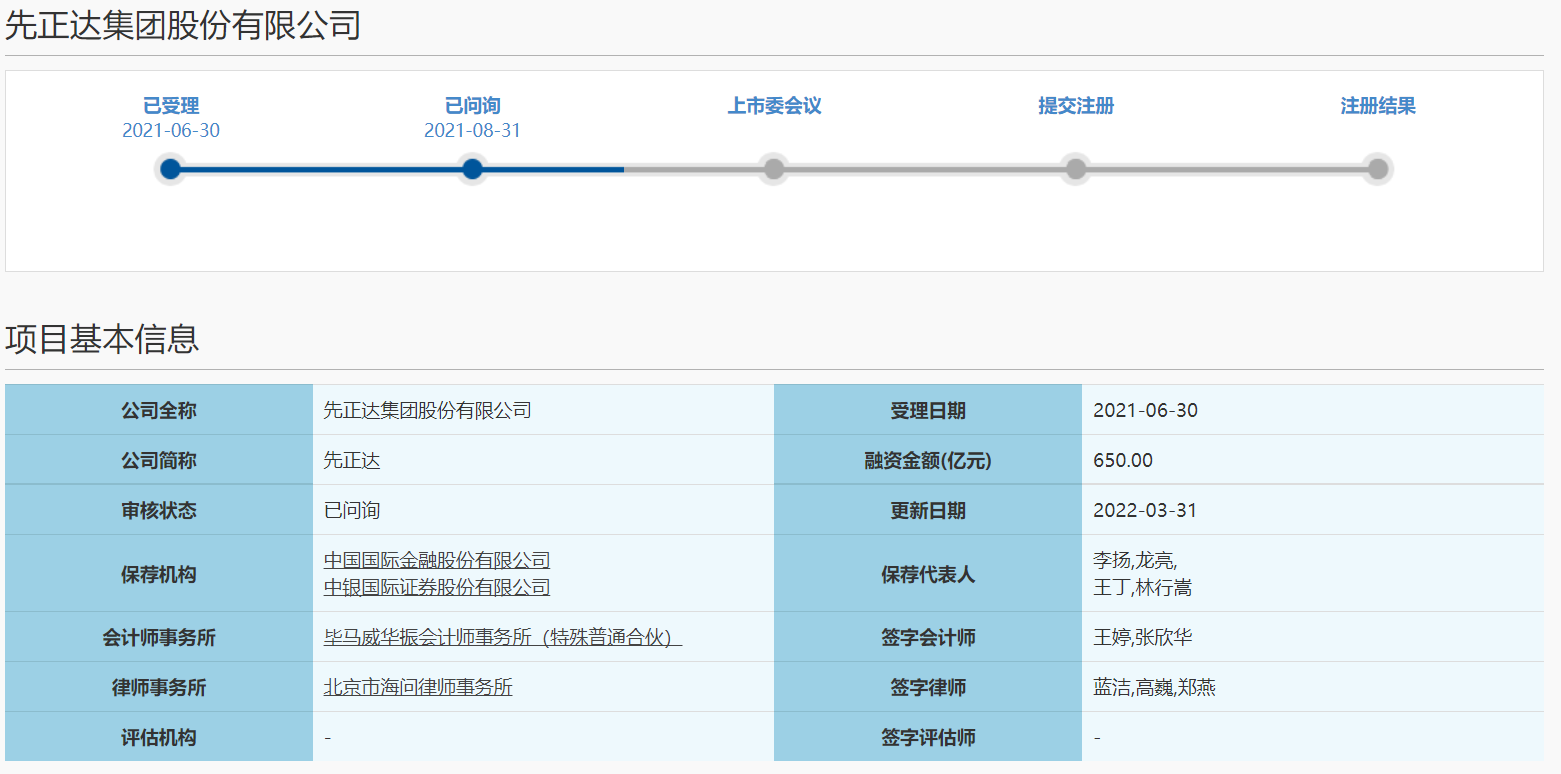
先正达回复科创板三轮问询 协议仅限制瑞士除草剂产品销售
-

转板第一股诞生!北交所首批企业观典防务成功过会
-
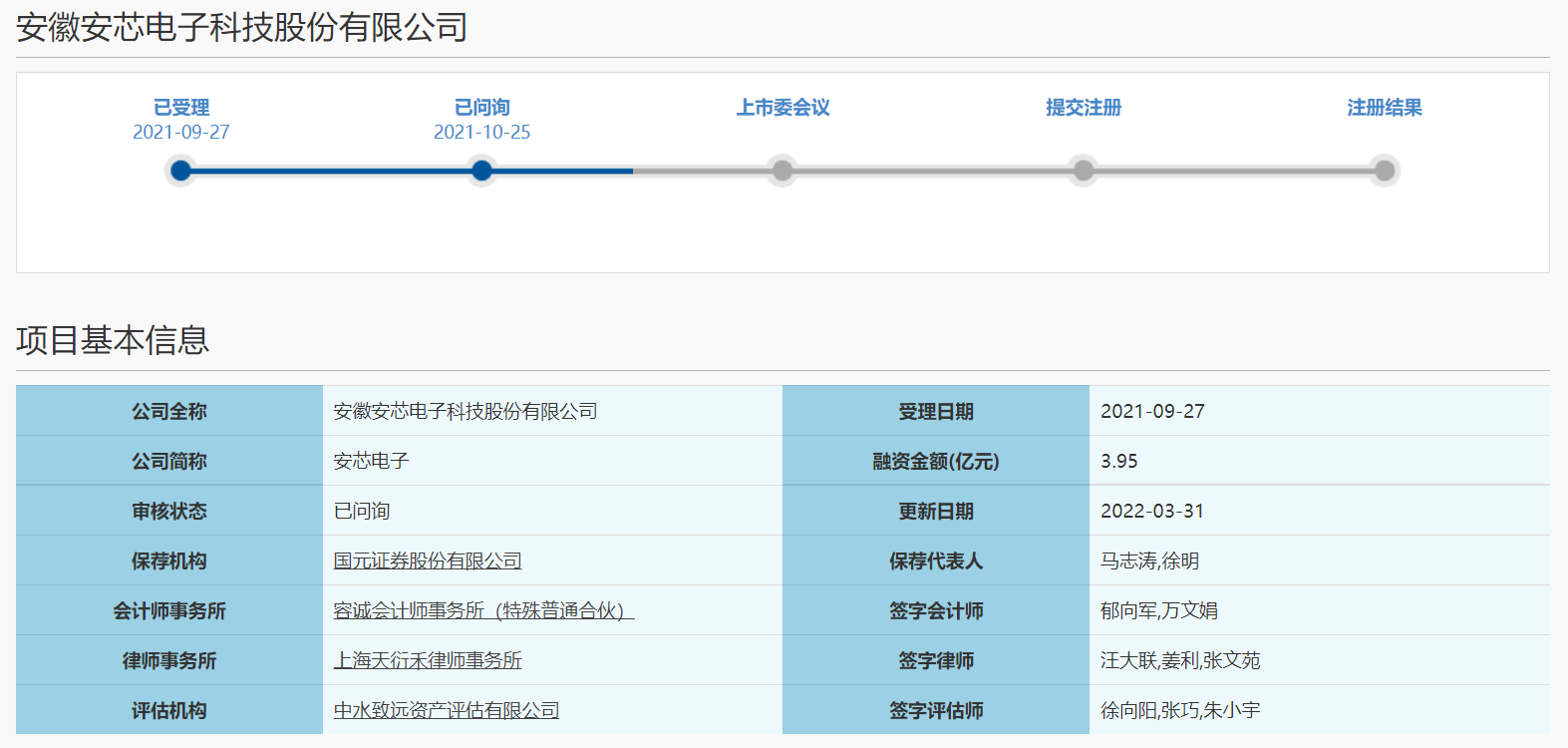
安芯电子回复科创板首轮问询 不直接向终端客户销售芯片
-

福州首批21个共享单车专用停车框启用 引进施划标线新技术
-

福州四大慢行步道沿线将试点彩色斑马线 标识牌增二维码
-

4月1日起实施!福建省直公积金中心可提取住房公积金支付首付款
-

覆盖所有设区市?福建省“十四五”深化医药卫生体制改革专项规划出台
-

一站办、就近办!福州自来水公司五四营业厅开放营业
-

雷允上集团研发及物流中心大楼项目奠基仪式圆满落幕
-

争创“全国法治政府建设示范市” 福州推进工程建设项目审批改革
-

福州协同推进建陶行业环境综合整治 助力一季度经济建设
-

福州港罗源湾港城可门作业区主体工程开工 加快打造亿吨大港
-

闽侯县:闽侯东南110千伏输变电工程等项目动工建设
-

不了解菜价的“小白”——记永泰县商务局工作人员杨煌
-
一嗨租车赤壁北站店更新升级 站内取还更便利
-

圣迪乐守“沪” 记录疫情封控区的圣迪乐团队真实的一天
-

第二届有觉321睡眠文化节:睡眠快闪体验,开启智能睡眠新时代
-
润迈德:志存高远,逐步打造“无人手术室”
-

中国服装业百强“报喜鸟”签约群杰,解锁印章智能管理
-

从医药到户内中水系统,国外企业恶意打压中国企业正轮番上演!
-
这 4 位Haylou的年轻人,都和我们聊了啥?
-

不再“步步惊心”!长乐区江田镇面前港河段新装石护栏
-

剑南春谱写民族品牌新诗篇
-

为期3个月!福州市开展建筑工地夜间施工噪声专项整治行动
-

推进河湖“清四乱”常态化 长乐吴航街道探索河湖长制新模式
-

数字赋能医疗行业!福州与清华大学共建智能医学影像项目部
-

福州港罗源湾南北航路正式通航 加快南北两岸水水转运效率
-

“榕城绿”来了!共享单车专用停车框在福州市推广
-

福州市出台价格临时补贴联动机制 缓解物价上涨
-

闽侯县举行3月份重大项目集中开工仪式 总投资额为48.4亿元
-

吹响并网发电集结号 永泰抽水蓄能电站下闸蓄水实现一季度“开门红”
-

总投资182.15亿元!福州新区28个重点项目集中开工
-

广州18宗住宅用地挂牌出让 起始总价为367.73亿元
-

有温度,有速度,更有力度! 顾家家居12亿助商资金助力事业伙伴发展
-

中国人的美食榜:2022黑珍珠餐厅指南发布 浙江24家上榜
-
咬定全年目标不放松!国常会再聚焦稳增长,机构齐呼主线来了
-
中国人口十年图谱|出生率持续下降,去年至少9省人口出现自然负增长
-
华夏幸福:累计实现债务重组1048亿元,减免利息等87亿
-
奥地利新研究提示:新冠肺炎后很长时间内仍可观察到肺部异常
-
媒体聚焦殡葬业:有墓地售价近16万,上市公司毛利率超80%
-
解密最后的“空白区”:首个完整无间隙人类基因组序列公布
-
上海成交四幅城中村改造宅地 总价44.184亿
-
牛市早报|美股创两年最差单季表现,联盛化学今日申购
-
中国武夷(000797.SZ)拟向添宜发展出售福州武夷中心房产 预计产生净利润约6000万港元
-
科通芯城(00400)拟400万美元出售COMLINK HOLDINGS 70%股权
-
研祥智能(02308)发布2021年业绩 净利1.17亿元 同比减少44.4%
-
百济神州(06160.HK)因受限制股份单位获归属发行30.303万股
-
和誉-B(02256.HK):在研口服PD-L1小分子抑制剂ABSK043临试申请获国家药监局批准
-
生命教育的探索之路——读刘亚洋《家庭教育新论》
-
三亚中小学幼儿园4月1日至2日停课
-
其实,大学才是人生真正的起跑线
-
福州老师到处“蹭网”!学生却纷纷点赞
-
学生招不满、老师被挖走…县中如何振兴?
-
你好,教育早新闻来了(2022.04.01)
-
留学中介服务乱象调查:“背景提升”竟成生意?
-
原来你错了很多年!
-
怎么看待现在中学生早恋成风现象?
-
初试390分不敌331分合理吗?北京协和医学院回应:未发现违规行为
-
迪信通(06188)发布2021年中期业绩 拥有人应占亏损34.4亿元
-
瑞风新能源(00527)发布2021年业绩,股东应占亏损3.686亿元,同比扩大73%
-
中基长寿科学(00767.HK)年度实现归母净利1852.9万港元
-
星星集团(01560)发布2021年业绩 股东应占亏损3713.4万港元 同比盈转亏
-
迪信通(06188)延迟刊发2021年业绩
-
东吴证券股份有限公司上调中微公司评级
-
上市公司又掀回购潮 传递积极市场信号
-
农产品牛市推助业绩润丰股份首季业绩大幅预喜
-
华福证券有限责任公司上调贵州茅台评级
-
奇信股份被证监会立案 公司曾自查发现大额资金流出
-
幼儿园3年,疫情占了三年!这届孩子带了两年半,见面却没超过二百天~
-
研究生复试331逆袭390,是否违规?北京协和医学院:考试成绩有效
-
14所高校入选国家重要项目,除两所师范大学之外,其余都是双一流
-
家里没钱没背景的学生,报考这4个专业,毕业后一样端起铁饭碗
-
地理信息科学:计算机专业吗?
-
盘点院校前身之东北农业大学
-
走近大学:山西篇001-山西大学
-
温州美女学霸,被世界名校录取!
-
盘点地方学院硕士点之新乡医学院
-
盘点地方学院硕士点之天津农学院
-
清华园里的非典记忆





