创新药出海道阻且长 信达生物PD-1赴美上市遇阻
2022-02-11 19:49:02 来源: 证券日报网 张敏
本报记者 张敏
信达生物的PD-1出海进展牵动着医药创新市场的神经。
2月11日,信达生物发布公告称,美国食物药品监督管理局(FDA)召开肿瘤药物咨询委员会(ODAC),对信迪利单抗注射液的新药上市申请(BLA)审评问题进行讨论并投票。
从最终公布的信息来看,信达生物过这一关仍需更多准备。信达生物公告称,委员会投票建议需要在获批前补充额外临床试验,证明信迪利单抗在美国人群和美国医疗实践中的适用性。
受此消息影响,信达生物2月11日二级市场一度大跌超10%,午后跌幅收窄,当日收盘下跌7.47%。同花顺数据显示,2022年以来,信达生物的总市值已经缩水超200亿港元。
公司称将继续完成相关评审工作
信迪利单抗是一款创新PD-1抑制剂,由信达生物与礼来制药公司共同开发和商业化。此次BLA申报适应症为信迪利单抗注射液联合培美曲塞和铂类用于非鳞状非小细胞肺癌(nsqNSCLC)一线治疗,主要基于在中国开展的ORIENT-11临床三期试验资料。
之所以此次会议备受关注,因其是中国药企第一次通过ODAC审评会议形式与FDA对话。而对于FDA来说,信迪利单抗是首个基于美国以外单一国家/地区临床数据的药物寻求批准。这场会议关乎信迪利单抗能否成为首个在美国获批上市的国产PD1单抗,也对后续其他国产PD-1单抗在美上市、中国创新药出海具有重大参考意义。
信达生物表示,公司和礼来制药将继续与FDA配合完成新药上市申请的审评工作。ODAC就已上市和临床中的肿瘤药品,为FDA提供独立的专业性意见。FDA在新药审批过程中将采纳ODAC的投票意见,但ODAC投票意见不具有对FDA决策的约束力。
信达生物制药集团总裁刘勇军表示:“我们很高兴有这个机会向FDA和专家委员会展示ORIENT-11的数据。FDA没有任何对于信迪利单抗安全性问题的质疑。虽然对于这次ODAC投票结果感到遗憾,我们将与礼来共同配合FDA继续完成BLA申请的相关审评工作。”
针对未来的上市规划,信达生物在回复《证券日报》记者采访时表示:“ODAC会议大家也看到了,虽然大部分专家都觉得需要补一些数据,但是专家的意见里,做怎样的临床来补数据没有一个统一的认知,接下来礼来与信达将会与FDA去沟通。在获得FDA更多反馈之前,我们无法对未来的试验进行猜测。”
针对此事,一位不愿具名的业内人士向本报记者介绍,尽管FDA未给出最终的结果,但态度似乎已经很明朗,国内已经有做PD-1的药企启动了补充美国三期临床方案。
国产创新药何去何从?
PD-1/PD-L1抑制剂作为广谱抗肿瘤药物,在抗肿瘤历史上具有划时代意义。
公开信息显示,目前,FDA已经批准了7款PD(L)1单抗,价格一直居高不下,均在15万美元左右。而我国获批的PD-1数量已达到8款,其中进口的2款,国产的6款。国产PD-1持续上市,拉低了产品销售价,在中国上市的PD-1年治疗费用从最初的30万元以上已被拉到了10万元以下。出海至美国市场已经成为国内PD-1药企的重要目标。
除了信达生物,君实生物、百济神州、康方生物等国产PD-1企业也已向FDA递交上市申请。不过据媒体报道,康方生物已经与FDA完成了三期临床方案的沟通和讨论,正在按照FDA指引推进一线鼻咽癌的三期确证性临床研究的相关工作。
百济神州向本报记者介绍:“公司自主研发的抗PD-1抗体替雷利珠单抗从进入临床阶段之初即采取全球化开发策略,拥有广泛的全球临床开发项目。公司对于替雷利珠单抗针对ESCC(用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌)在美国FDA的新药上市申请的进展非常有信心。此次申请是基于一项全球3期临床试验的研究结果,该试验纳入了512例来自亚洲、欧洲、北美的11个国家或地区的患者,近40%的患者是在中国以外招募,其中也覆盖了美国多个临床试验中心。”
值得一提的是,信达生物此次失利不仅关乎PD-1赛道,也影响到其他国内创新药企出海的策略制定。“我们也都在关心此事的进展。如果不通过,确实会对中国的创新药出海产生打击。”一位不愿具名的创新药企向记者介绍。
去年12月份,另外一家创新药企万春药业的普那布林在美上市也遭拒。彼时,美国FDA在审评意见中指出,仅一个注册临床研究(普那布林106三期临床研究)的数据不足以充分证实普那布林的临床价值;还需要第二个对照注册临床研究来提供充分的证据支持关于预防化疗引起的中性粒细胞减少症的NDA;FDA无法基于目前的数据批准该项NDA。据媒体报道,万春医药的普那布林临床III期入组患者中,仅有13%来自美国和澳大利亚,剩余87%均来自中国。
创新药出海道阻且长。信达生物的“失算”也影响了港股医药股的市场情绪。一位私募投资人向记者表示,此事对本已深度调整的医药股再度产生冲击。
未来,中国的创新药企出海将如何调整策略?本报将持续关注。
(编辑 乔川川)
热门资讯
-
创新药出海道阻且长 信达生物PD-1赴美上市遇阻
-
熊猫乳品:股东拟减持不超过2.00%的股份
-
FLCEAsia2022亚洲食材展 聚焦预制菜展
-
浦东城管世博中队:对世博源餐饮企业开展飞行检查
-
Meta Media!《周末画报》母公司将更名抢滩元宇宙
-
温氏股份:1月肉猪销量环比增23%,毛猪均价环比降13%
-
秦洪看盘|担忧犹存,谨慎情绪蔓延
-
外汇局:2021年直接投资顺差2048亿美元,较上年翻倍
-
恒锋信息:股东拟减持不超过0.27%的股份
-
养老理财产品试点扩容,贝莱德建信获批在广州、成都开展试点
-
业绩快报:华瓷股份全年净利1.37亿 同比增长16.29%
-
多地掀起虎年春耕热潮 上市公司鼎力打好农业生产开年第一仗
-

持续升温的元宇宙,究竟离我们有多远
-
理财资金高达25亿元 南极电商交易标的难言优质
-

方久尼大桥正式开通 塞内加尔最长桥梁建成
-

“墩壳”厂商谋扩产能 冰墩墩概念股接连涨停
-

洲际CEO:全球最快增长市场 中国正成为世界旅游强国
-

温州银行拓宽融资渠道 加大企业开工资金支持力度
-

浙江省发文批复 瓯海创建省级高新园区获批
-
A.O.史密斯解密:如何能随时喝到温度适宜的热水?
-
“冰冻”的广州楼市:中介放话“房贷4周内放款”
-
火车也有“月票”了!12306有售
-
超5万现金存取为何要登记?如何保护客户信息?央行回应
-
大盘下行:成交近万亿,逾四千股收跌,大金融两桶油护盘未果
-
冠城大通回复上交所:房地产项目存货存在进一步计提减值风险
-
港龙中国地产:1月实现销售额14亿元,同比下滑55%
-
两部门将派联合调研组开展铁矿石市场监管调研:严打囤积居奇
-
云拜年·抽锦鲤丨春节返程安心出行,大年初六抽奖送100份50元曹操出行乘车券
-
云拜年·抽锦鲤丨一箱一年味 封面新闻携手京东快递送出10万元快递优惠券
-
恐龙也“感冒”?国际最新研究发现首个相关证据
-
正荣地产、正荣服务盘中闪崩 股价暴跌逾80%
-
海南:累计开立数字人民币个人钱包超1046万个
-
全球可乐、咖啡价格上涨,饮料低价销售将不复存在?
-
千万持股被司法冻结近一月才披露 紫天科技控股股东遭监管警示
-
业绩快报:武进不锈全年净利1.75亿 同比下降20.71%
-
美畅股份拟对生产线实施技改 将提升年产能超 2300万公里以上
-
强化新材料业务 多氟多子公司增资扩股引入战投
-
业绩快报:汉钟精机全年净利4.87亿 同比增长34.05%
-
常山北明拟共同投建冷链物流产业园项目 预期贡献年营收5800万元
-

温州鹿城政企携手冲刺“开门红” 推动辖区经济跨越式发展
-
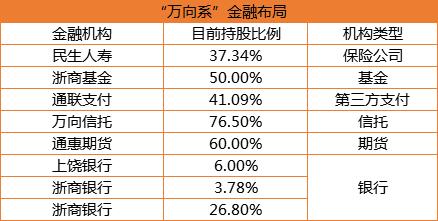
央行连发两则公告 万向控股或成国内首家民营金控公司
-

2022年新能源发展定调 敲响远东股份高质量发展“最强音”
-

私自销售假冒“冰墩墩”“雪容融”?浙江省查处相关案件26件
-

浙江省市监局印发二十条通知 持续激发市场主体活力
-

招行信用卡7年蝉联中国顾客推荐度指数第一
-
2022年首月上海港集装箱吞吐量突破435万标准箱
-
借“冬奥”之风 申城“冰雪消费”持续升温
-
微博:言语攻击冬奥解说员或挂出其隐私,4239个账号被禁言
-
关于NFT、元宇宙,YouTube首席产品官谈了新年计划
-
分析|1月金融数据大爆发:能持续多久,政策会继续加码吗
-
广州楼市:中介放话“房贷4周内放款”,新房限价政策传闻有松动
-
南非总统:“众筹”为南非抗疫发挥重要作用
-
年薪25至35万,上不封顶!中国联通松江分公司正在招人→
-
知情人士:正荣地产仍会按计划赎回2亿美元永续债
-
中美前财长对谈:需顶住“脱钩”压力,加强对话合作
-
国联证券股份有限公司上调中国电信评级
-

冬奥元素火热,冰雪旅游“燃”起来还要这样做
-

全系搭载鲲鹏动力2.0T,捷途X90子龙将于2月28日正式上市
-
大金融及两桶油护盘:沪指半日微涨,但3637家收跌
-
A股大金融爆发:午盘收盘保险领涨行业,城商行持续上涨
-
“G60科创之眼”首发产业地块即将摘牌,5月正式开工
-
国家医保局:药品集采提速扩面是常态化、制度化应有之义
-
1月份人民币贷款同比多增3944亿元——货币政策持续发力效果显现
-
存煤平均可用天数达23天——国内电厂煤价理性回归
-

时空道宇领航智慧出行:大规模商用即将展开
-
天威诚信深契业务需求,推进保险行业安全合规建设
-

开年大动作|来酷科技新年七店同开,给生活来点酷的
-
法国物价加速上涨 预计2022上半年涨幅高于预期
-
农资先行 不误农时(田间地头看春耕)
-
创40年新高!美国1月CPI同比大涨7.5%
-
乡村消费天天旺 农民生活步步高(乡亲们的身边事⑩)
-
奉贤城管:“力度与温度”并存 柘林中队助力企业复工复产
-
2022年上海市进出口公平贸易公共服务项目预申报通知
-
让乡亲们的日子越过越殷实
-
要求补充额外临床试验,国产PD-1首次闯关FDA遇挫
-
网信证券重整落地:指南针成重整投资人,有望转型互联网券商
-
乐视网被恢复执行12.9亿元,目前被执行总额约超13亿元
-
新物种测评 | 怪味汤圆评测,竟然还有让人想蘸醋的口味 |封面天天见
-
国家医保局:到今年底实现集采药品合计数每省350个以上
-
金徽股份今日申购 发行价格10.8元/股
-
天佑德酒:股东拟减持不超过2.00%的股份
-

EduSoho携手化工社推出化工安全教育公共服务平台,推进安全教育
-

城乡社区服务体系建设规划出炉 助推基本公共服务资源下沉社区
-

红河州重点项目掀热潮 完善河口跨境经济合作区设施
-

主攻工业经济发展提速 宾川集中力量打好工业攻坚战
-
榕树贷款拥抱数字化潮流 精准匹配信贷供需
-

宣威市人民检察院持续推进司法体制改革 充分履行法律监督职能
-

应收账款周期拉长 建行云南分行普惠贷款提速扩容
-

云天化与中石油协会签合作协议 首个石油焦流通标准库落户?
-

勉励企业抢抓开局 深沪镇规上企业开工率约68%
-

晋江市池店镇:三种方式保障用工需求 助力企业实现“开门红”
-
九安医疗:目前美国供需紧张情况有所缓解,交货排期有所缩短
-
市经济信息化委召开提升城市软实力要求下发挥上海产业支撑作用研究专家结题座谈会
-
发文规范现金存取业务流程 反洗钱力度再升级
-
合生创展1月份销售额29.99亿元,同比上升6.27%
-
高标准农田建设提速(新春走基层)
-
优质田管护落在实处(新春走基层)
-
好消息!松江多家企业拟入选“市级示范”
-
松江这四条道路获评市级特色户外道路(街区)称号,在你家附近吗?
-
同城化发展有力推进





