凯因科技2023年半年度董事会经营评述
2023-08-24 17:26:12 来源: 同花顺金融研究中心
凯因科技2023年半年度董事会经营评述内容如下:
一、报告期内公司所属行业及主营业务情况说明
 【资料图】
【资料图】
热门资讯
-

凯因科技2023年半年度董事会经营评述
-

信德新材2023年半年度董事会经营评述
-

联合光电:截至2023年8月18日,公司股东人数为18,240
-

北京京客隆(00814)公布中期业绩,净亏损3778.2万元 同比盈转亏
-

川环科技(300547.SZ)董事长文琦超提议以1000万元至2000万元实施回购
-

爱尔眼科(300015.SZ)半年报:营收超百亿元,归母净利润升32.61%至17.12亿元
-

百宏实业(02299.HK)8月24日以3.19万港元回购8000股
-

马銮湾熹海高级中学建成 可提供2400个普通高中学位
-

一财社论:用定价自由缓释楼市风险敞口
-

亚运会临近 各赛事举办城市以崭新形象营造亚运氛围
-

北京老字号将首次以专题展亮相服贸会 近60家企业参展
-

“产品+客户”拓展驱动业绩增长 宁波华翔上半年净利同比增长45.53%
-

吉电股份发布“氢基绿能+零碳供能”两大产业应用 助推新型能源体系建设
-

颀中科技上半年营业收入6.89亿元 稳居国内细分领域龙头
-

小鬼子是真鬼
-
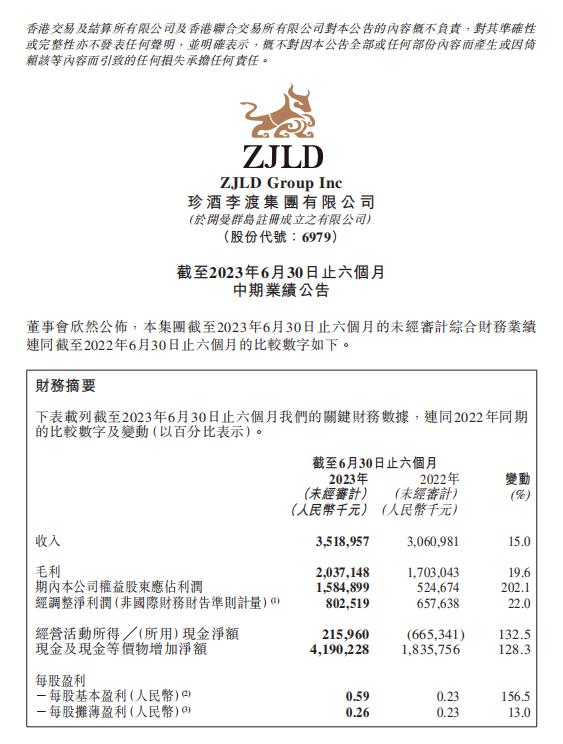
营收利润双增长,珍酒李渡半年成绩亮眼
-

中考前从公立出走,我让自己「卷」在刀刃上
-

鹏翎股份(300375.SZ):与小米汽车有合作
-

兰剑智能(688557.SH)发布半年度业绩,净利润5303万元,同比增长69.77%
-

恒天海龙(000677.SZ)发布上半年业绩,净利润2507.46万元,同比下降17.25%
-

黄山旅游(600054.SH):2022年净亏损1.32亿元
-

【行情】全国碳市场每日成交数据20230824
-

澜起科技上半年归母净利同比下降近九成 津逮®服务器平台产品线销售疲软
-

40款新车搭载Cipia驾驶员监控系统 更安全
-

3D打印马桶!高校团队打造光滑马桶
-

薛城区常庄街道到养老公寓为集中供养老人义务健康体检
-

取消核心课程与大规模裁员背后:美国公立大学的困境与未来
-

2024研招《教育综合考试大纲》公布 教育专业学硕将增设全国统一命题科目
-

总金额2.72亿元!国网信通全资子公司中标内蒙古电力(集团)项目
-

晶盛机电(300316.SZ):目前公司已基本实现8-12英寸大硅片设备的全覆盖并批量销售
-

港股异动 | 九毛九(09922)涨超7%领涨餐饮股 餐饮恢复确定性高 下半年传统旺季有望催化行业向上
-

日辰股份(603755.SH):公司目前不具备食盐生产能力且无食盐供销业务
-

电科数字(600850.SH):公司为多个行业客户提供数据综合解决方案
-

公牛集团(603195.SH):新能源业务产品不存在过度依赖个别供应商的风险
-

中银国际证券股份有限公司上调深南电路评级
-

全球能源绿色低碳转型的步伐放缓了吗?
-

北京绿色交易所王乃祥董事长受聘担任塞罕坝生态文明创新研究院首任院长
-

复旦案例库研究助力品牌生态繁荣,赋能企业可持续发展
-

核污染概念持续活跃 江盐集团3连板
-

女孩给大爷让座被赠2盒蓝莓当事人:我也回赠了芒果快节奏生活里遇到这种事很暖心 具体是怎么回事?
-

现场画面!日本核污染水排海 具体是怎么回事?
-

生意社:短期内水泥市场行情仍以下跌为主
-

诺思兰德H1亏损去年前年均亏 正拟定增募资不超2.3亿
-

3分钟看懂中集车辆(301039.SZ/01839.HK)2023年中期报告
-

中国人寿胡锦:会持续进行派息政策优化研究
-

通用汽车(GM.US)宣布停止亚利桑那州IT业务 裁员940人
-

讲述应对气候变化中国故事 打造绿色发展全球IP符号 “上海气候周”在沪发布并启动
-

深圳排放权交易所关于周末临时开市的公告【8月26日(周六)和8月27日(周日)】
-

研究表明将碳封存在海底以下,地震风险最小
-
金秋相聚石景山,2023服贸会等你来
-

技术创新要注重成果应用
-

恒玄科技首次回购公司股份
-

诚意药业上半年实现净利9059.9万元 同比增长39.48%
-

总金额2.72亿元!国网信通全资子公司中标内蒙古电力(集团)项目
-

16家A股公司今日股权登记 万科派现力度最大
-

*ST商城:经预重整评审委员会遴选确定重整投资人后,公司将披露重整投资人等情况
-

华金证券:给予开立医疗增持评级
-

平安证券:给予金山办公增持评级
-

华西证券:给予豪美新材买入评级
-

合肥百货:1.肥西物流园未来所出售的商铺和住宅所产生的收入将计入上市公司的主营业务收入
-

盐城环保科技城:布局绿色产业 践行低碳理念
-

不同轮伐期对杉木人工林碳固存的影响
-

康士伯海事专家谈脱碳及船舶合规
-

河北省工业企业“公转铁”碳减排量有了“度量衡”
-

西宁经济技术开发区加快推进零碳产业园区建设
-

东方甄选入驻淘宝,俞敏洪率队开播
-

梦见被蛇咬什么意思
-

未来北京市将实现双智专网覆盖 智能交通没问题
-

《NBA 2K24》新功能上线:全新“勒布朗时代”
-

2023年全国早稻产量同比增长0.8% 单产小幅增长
-

四部门将密切合作 查处“天价”月饼违法违规行为
-

大连普兰店发生4.6级地震,消防救援队伍已赶赴震中踏勘
-

自然资源部:推动测绘地理信息数据安全有序开放
-

经济发展新动能指数增长近三成
-

亚运会倒计时30天|杭州@所有人
-

丝路视觉:截至2023年8月18日,公司在册股东为22760户
-

中国通信服务(00552)发布上半年业绩,股东应占利润20.34亿元 同比增加7.33%
-

秦川机床(000837.SZ):控股股东承诺6个月内不减持公司股份
-

中鼎股份(000887.SZ):控股股东承诺1年内不减持公司股票
-

东亚银行(00023)将于10月5日派发中期股息每股0.36港元
-

云南出台城乡建设领域碳达峰实施方案
-

水泥行业纳入全国碳市场倒计时,这一行业减排有多难?
-

美参议员:中美须携手应对气候变化
-

全国首个“负碳海岛”长啥样
-

重庆出台减污降碳协同增效实施方案 2025年规上工业单位增加值能耗降低14.5%以上
-

接触过数不清的中产家庭,他说很多家长对孩子“英语好”的认知,还滞后在二十年前
-

暑假还没结束,已经花了四五万,看家长如何评“假”
-

咱就是说,不花钱没法过暑假吗?
-

我国新生儿遗传代谢病和听力障碍筛查率均达到90%以上
-

港股异动 | 名创优品(09896)涨超5%再创新高 美银称业绩超预期 店铺销售效率较高
-

西南证券:数据入表施行在即 数据资产化时代开启
-

德尔玛(301332.SZ):净水产品主要应用于家用场景下饮用水过滤
-

港股异动 | 电视广播(00511)绩后跌超4% 上半年净亏损同比扩大81.34% 电子商贸分部收入跌超四成
-

光峰科技:收到华域视觉开发定点,将供应PGU显示模组产品
-

小米MIX Fold3跌落测试,小米这次用黑科技打败了魔咒
-

如何减少健康领域科学研究的碳排放?
-

赣浙两法院共同建立生态司法碳汇修复基地
-

天津宝坻区积极推进工业领域减污降碳协同增效
-

“城市碳中和实践研讨会”圆满举行
-

工业和信息化绿色低碳标准化工作调度推进会在京召开





